n. 14 - L'epatite B
n. 20 - Le malattie non virali del fegato n.19 - Dosaggio degli analgesici e cirrosi epatica n. 18 - Fegato e farmaci n. 17 - Il carcinoma epatocellulare (HCC) n. 16 - Fegato grasso n. 15 - Malattie epatiche e abuso di sostanze n. 14 - L'epatite B n.13 - L'epatite autoimmune n.12 SARS-CoV-2 (COVID-19) E FEGATO n.11 CEUS (Contrast Enhanced Ultrasound) n.10 Encefalopatia epatica n.9 - Epatite E n.8 - Morbo di Wilson n.7 - Biopsia epatica n.6 - Iperferritinemia nello studio medico n.5 - Epatopatia alcolica n.4 - Fegato grasso n.3 - Trattamento innovativo dell’ascite n.2 - La colangite biliare primitiva n.1 - I nuovi farmaci contro l'epatite CPRIMO PIANO
Malattia infettiva poliedrica che comprende una maggioranza di infezioni asintomatiche e non evolutive, frammiste ad infezioni rapidamente evolutive verso complicanze letali quali la cirrosi, l’insufficienza epatica terminale e/o l’epatocarcinoma. Trattasi di una delle più comuni infezioni croniche a livello mondiale e, essendo un virus fortemente oncogenico, è la più importante causa di epatocarcinoma (HCC) a livello mondiale. La storia naturale dell’infezione da HBV è complessa e va sempre ricordato che HBV, vista la sua capacità di integrare il suo materiale genetico nel nucleo dell’epatocita, non viene mai completamente eliminato dal corpo (anche nei casi di apparente guarigione). Questo spiega il fatto che l’infezione può sempre riattivarsi in caso di immunosoppressione.
Gli attuali trattamenti permettono un ottimo controllo della malattia ma non l’eradicazione del virus. La ricerca negli ultimi anni si sta muovendo con l’obiettivo di trovare una cura definitiva ma, dal momento che si tratta di un virus in grado di integrare il suo DNA nel nucleo dell’epatocita (e financo nel DNA umano), le difficoltà nel raggiungimento dell’obiettivo sono notevoli ma superabili nel medio periodo visto i costanti progressi scientifici cui, anno dopo anno, assistiamo in ambito sanitario.
LA PAROLA ALL'ESPERTO
Dr. med. Lorenzo Magenta
Vicedirettore, Epatocentro Ticino
Medico consulente Clinica Luganese Moncucco
>> Visita il profilo
Andiamo a conoscere meglio questo complesso virus e le svariate evoluzioni che possono scaturire dall’interazione tra il virus stesso e l’organismo umano.
Virologia e immunopatogenesi: HBV è un virus a DNA appartenente alla famiglia degli Hepadnaviridae e al genere Orthohepadnavirus. Il DNA virale, che codifica le proteine virali, è racchiuso all’interno di un nucleocapside costituito da una proteina strutturale (Antigene core o HBcAg) e da una proteina non strutturale (Antigene e o HBeAg). Il nucleocapside è rivestito esternamente da un involucro lipidico, che esprime sulla superficie l’antigene di superficie dell’epatite B (HBsAg, antigene Australia). Il ciclo vitale di HBV si attua in 5 passaggi: attacco e penetrazione del virus negli epatociti attraverso il legame con recettori della membrana cellulare; penetrazione del DNA virale nel nucleo della cellula e sua conversione in una forma circolare covalentemente chiusa (cccDNA), che funge da stampo per la duplicazione del genoma virale; trascrizione del cccDNA a opera di una RNA-polimerasi in forme multiple di RNA; migrazione di parte dell’RNA genomico nel citoplasma, ove viene utilizzato come RNA messaggero (mRNA) per la sintesi delle proteine virali, mentre un’altra parte funge da stampo per la sintesi di nuovo DNA virale; assemblaggio delle particelle virali e liberazione dei nuovi virioni in circolo. Il DNA virale può anche venire integrato nel genoma della cellula infetta, incorporandosi dove esistono fratture nel DNA cellulare. L’integrazione dell’HBV-DNA correla con la presenza dell’HCC dal momento che l’85-90% degli HCC associati all’epatite cronica B contengono infatti sequenze virali integrate, molto meno frequenti nel tessuto epatico non tumorale.
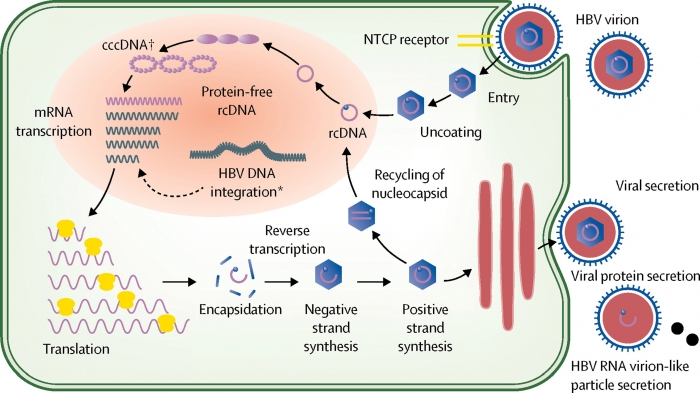
Wai-Kay S et al. Lancet 2018; 392: 2313-2324
Sono noti 10 diversi genotipi e 4 maggiori sierotipi. Inoltre in molti portatori cronici di HBV possono emergere varianti del virus a causa di mutazioni che si verificano durante la replicazione virale. Tra le mutazioni piu’ frequenti vi è la mutazione della regione pre-core che impedisce la sintesi e la secrezione di HBeAg, costituendo un vantaggio biologico per l’HBV. Durante l'infezione da HBV la risposta immunitaria, con i linfociti citotossici in particolare, nel tentativo di arrivare alla clearance virale causa la gran parte del danno epatocellulare correlato all’epatite B. Di fondamentale importanza ricordare che, contrariamente a quanto si riteneva in passato, anche nei pazienti con anticorpi anti HBs ed anti HBc (quelli che impropriamente vengono definiti guariti), l’HBV-DNA tende a sopravvivere per tutta la vita integrato nel nucleo degli epatociti sotto forma di covalently closed circular DNA (cccDNA). Questa infezione latente mantiene attiva la risposta T cellulare che a sua volta permette il controllo a lungo termine dell’infezione. Oggigiorno si ritiene che la completa e spontanea eradicazione del virus avvenga solo in una piccola percentuale dei casi e questo spiega il perché il virus si possa sempre riattivare (anche diverse decine di anni dopo l’infezione) in caso di immunosoppressione.
Storia Naturale: l’epatite B cronica è un complesso processo dinamico che riflette l’interazione tra la replicazione di HBV e la risposta immunitaria dell’ospite. Non tutti i pazienti con una infezione da HBV hanno infatti un danno dalla stessa (una vera epatite cronica per intenderci). La storia naturale è stata schematicamente divisa in diverse fasi sulla base della presenza o meno dell’HBeAg, dei livelli di HBV-DNA, dei valori delle ALT e della presenza o meno di infiammazione e fibrosi epatica. La nuova nomenclatura (che a mio modesto parere non ha necessariamente contribuito alla chiarezza) si basa sulle differenti caratteristiche della cronicità: infezione versus epatite. La sottostante tabella mostra le diverse fasi dell’epatite B cronica confrontando la vecchia e la nuova nomenclatura, nonché le caratteristiche delle diverse fasi.
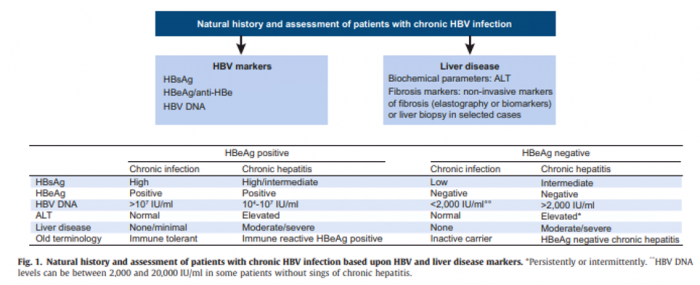
EASL 2017 Clinical practice Guidelines on the management of hepatitis B virus infection
È importante ricordare che una buona percentuale di pazienti hanno solo un’infezione senza vera epatite (i vecchi portatori inattivi e immuno-tolleranti), che richiede solo una sorveglianza senza una terapia antivirale, mentre una cospicua minoranza (quelli con l’epatite cronica) hanno forme aggressive che richiedono una rapida instaurazione di un trattamento prima che si arrivi in tempi rapidi alla cirrosi e/o all’HCC. I pazienti con la sola infezione possono nel tempo anch’essi evolvere verso un’epatite cronica e vanno quindi regolarmente sorvegliati.
Epidemiologia e interesse per la salute pubblica: come ben illustrato dalla sottostante figura, l’epatite B è la più letale tra le epatiti virali.
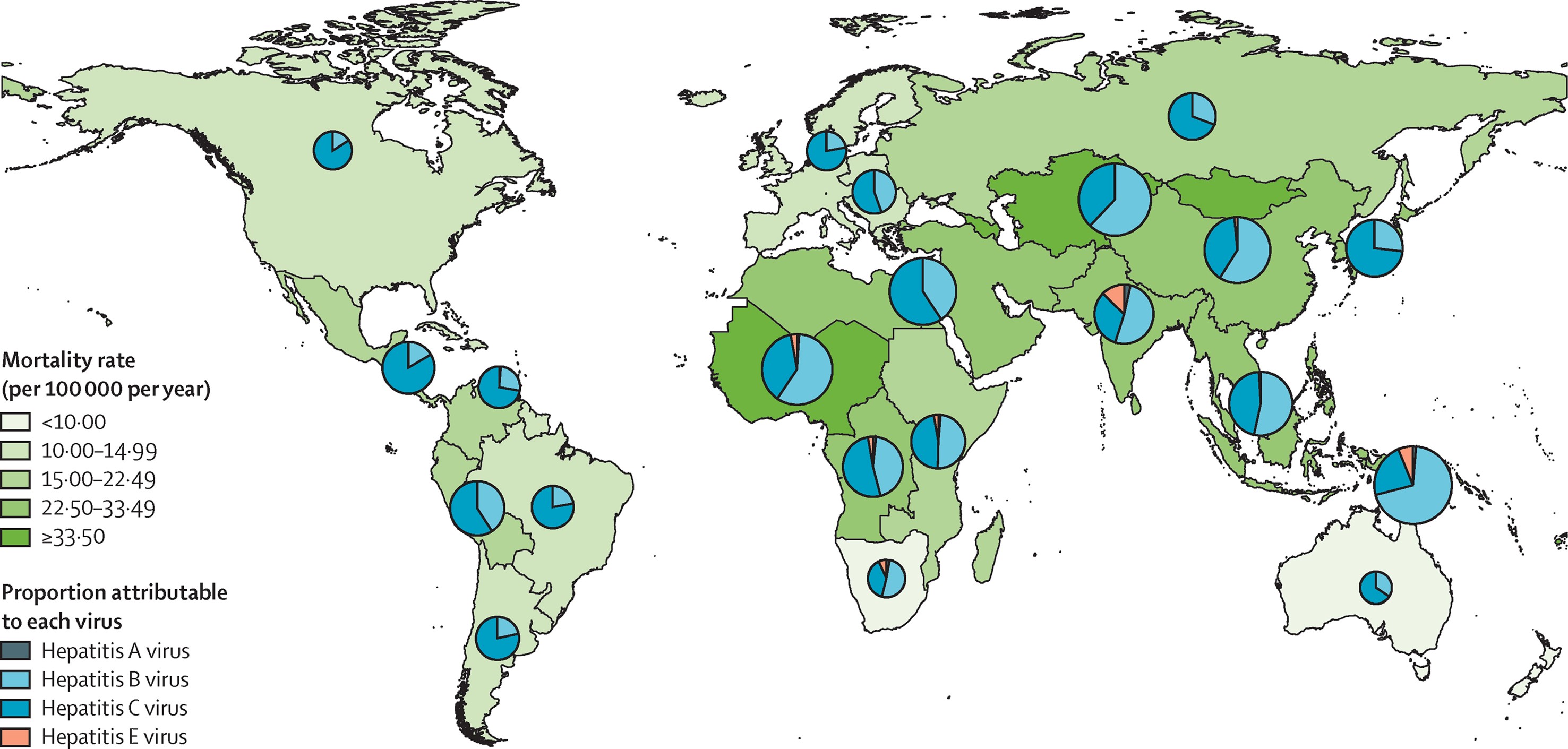
StanawayJD et al. Lancet 2016;308: 1081-1088
Circa un terzo della popolazione mondiale ha l’evidenza sierologica di una infezione da HBV presente o passata. L’Organizzazione mondiale della Sanità (OMS) stima che almeno 257 milioni di persone hanno un’epatite B cronica (definita come HbsAg positività), che provoca 887.000 morti all’anno, soprattutto per cirrosi e/o epatocarcinoma (WHO 2019). Si stima che il 53% degli HCC a livello mondiale siano dovuti al virus dell‘epatite B. C’è un ampio divario nella prevalenza dell’epatite B nelle diverse parti del mondo (variabile dallo 0.1% al 20% della popolazione). Le diverse prevalenze sono verosimilmente correlate alla diversa età di acquisizione, che ben correla con il rischio di cronicizzazione (inversamente proporzionale all’età di acquisizione). Le aree ad alta prevalenza (≥ 8% della popolazione) includono il Sudest Asiatico, la Cina, e l’Africa subsahariana, dove la probabilità di acquisire l’infezione nel corso della vita supera il 60%. L’Europa resta divista tra aree a bassa prevalenza (< 2% della popolazione) quali Italia, Germania, Svizzera, Regno Unito ed aree a prevalenza intermedia (2-7% della popolazione) quali Spagna e paesi dell’Europa orientale. La situazione è complicata dai flussi migratori dal sud del mondo che stanno modificando la situazione anche in paesi a bassa prevalenza. In Svizzera la prevalenza di epatite B cronica è intorno allo 0.53% della popolazione (equivalenti a 44.134 persone). Anche in Svizzera la maggioranza delle epatiti B croniche coinvolgono persone non nate in Svizzera (circa l’80%).
Modalità trasmissione: il virus dell’epatite B è molto contagioso e facilmente trasmissibile attraverso il contatto con i liquidi corporei (in particolare il sangue e le secrezioni genitali) di persone infette. Le modalità di acquisizione sono molto diverse nelle aree a bassa prevalenza, dove l’acquisizione avviene soprattutto attraverso rapporti sessuali non protetti (genitali, anali, orali) e scambio di siringhe tra tossicodipendenti, rispetto alle aree ad alta prevalenza dove le modalità di trasmissione prevalenti sono quelle materno-fetale in epoca perinatale e quella orizzontale tramite il contatto con piccole lesioni cutanee o con le mucose in ambito familiare e/o nei contatti tra bambini. Va ricordato che, in assenza di una profilassi i figli di una madre HBeAg positiva hanno una probabilità dell’80-90% di sviluppare un’epatite B cronica. Dal momento che la vaccinazione neonatale ha dimostrato un’alta efficacia, la trasmissione avviene verosimilmente al parto o subito prima. Altre possibili via di trasmissione (ormai molto rare all’infuori dei paesi ad alta prevalenza) sono l’acquisizione tramite trasfusioni di prodotti ematici, tramite trapianti d’organo, tramite tatuaggi o piercing e l’infezione nosocomiale (attraverso procedure mediche invasive e/o materiale per iniezioni contaminato).
Evoluzione clinica: il periodo di incubazione ha una durata variabile tra 30-120 giorni dopo il contagio. Durante questo periodo si può sviluppare una aspecifica serum sickness-like syndrome caratterizzata da febbre, rash cutaneo, dolori articolari, che cessano con l’insorgere dell’epatite acuta. L’epatite B acuta è anitterica e subclinica nel 70% dei casi, mentre meno del 30% sviluppa un’epatite itterica. I sintomi principali sono disconfort in ipocondrio destro, nausea, ittero, feci acoliche e urine ipercromiche nonché sintomi aspecifici (stanchezza, inappetenza, malessere, etc). I sintomi, quando presenti, si risolvono in 1-3 mesi ma può persistere una prolungata astenia. In questa fase le transaminasi (AST e soprattutto ALT) raggiungono valori molto alti (nell’ordine delle migliaia di UI/L). la bilirubina può anche aumentare ma nella maggioranza dei casi resta nella norma. Molto raramente (0.1-0.5% dei casi) l’epatite B acuta conduce ad una forma fulminante con insufficienza epatica che richiede in tempi molto rapidi l’esecuzione di un trapianto epatico per salvare la vita del paziente. L’epatite B acuta può risolversi con la sieroconversione o dar luogo ad un’epatite B cronica (definita dalla persistenza dell’HBsAg e/o dell’HBV-DNA per più di 6 mesi). Il rischio di cronicizzazione è molto diverso se l'infezione viene contratta in epoca perinatale (90% cronicizza), ad un’età compresa tra 1 e 5 anni (20-50% cronicizza) o in età adulta (meno del 5% cronicizza). La maggioranza dei pazienti con epatite B cronica è asintomatica, mentre alcuni hanno sintomi aspecifici quali stanchezza. In questa fase le transaminasi sono solitamente alterate in modo lieve-moderato e anche l’alfafetoproteina può essere aumentata. L’evoluzione dell’epatite B cronica dipende dall’interazione tra la replicazione virale e la risposta immunitaria dell’ospite che determinano se l’infezione si trasforma o meno in epatite con il relativo danno epatico a lungo termine. In assenza di trattamento si stima che il 20-30% dei pazienti con epatite B cronica vada incontro ad una cirrosi epatica. Di questi il 23% evolverà verso una cirrosi scompensata in 5 anni, mentre l’1-6% all’anno svilupperà un epatocarcinoma (HCC). Peraltro, a differenza di quanto avviene in corso di epatite C, l’HCC si può sviluppare anche nei pazienti con epatite B cronica senza cirrosi anche se con minori probabilità (0.2% all’anno). La replicazione virale (livello di HBV-DNA) è il marker principale di attività della malattia e correla con la sopravvivenza, la progressione di malattia e lo sviluppo di cirrosi e/o HCC. Altri cofattori che possono favorire l’evoluzione verso la cirrosi e/o l’HCC sono il consumo di alcool, la coesistenza di altre comorbidità epatiche (NAFLD/NASH, emocromatosi, etc) e/o altre epatiti virali croniche (HCV ed epatite delta in particolare). Nei pazienti cirrotici deve essere messo in atto uno screening semestrale dell’HCC con ecografia epatica e determinazione dell’alfafetoproteina. Infine nel 10% dei pazienti con epatite B cronica possono esser presenti due tipi di manifestazioni extraepatiche quali la poliarterite nodosa e la nefropatia/glomerulonefrite.
Diagnosi epatite B: la diagnosi dell’epatite B (che va esclusa in tutti i casi di transaminite non altrimenti spiegata) implica l’esecuzione di test sierologici quali l’HBs Antigene (HBsAg), l’HBs anticorpo (Anti HBs) e l’anti HBc anticorpo (anti HBc) per lo screening. Dalla diversa combinazione dei risultati sierologici si può determinare se il paziente ha uno:
- stato dopo epatite B (anti HBs+ ed anti HBc+)
- stato dopo vaccinazione anti epatite B (solo anti HBs+),
- epatite B occulta (solo anti HBC+) che può indicare sia un epatite acuta, che guarita o cronica e merita quindi ulteriori accertamenti
- un'infezione/epatite B cronica (HBsAg+ e anti HBc+, anti HBs negativo). Se l’HBsAg è positivo devono inoltre essere determinati l’antigene HBe (HBeAg) e l’anticorpo anti Hbe (anti HBe) oltre che la carica virale (HBV-DNA). Indispensabile se l’HBsAg o l’HBV-DNA sono positivi procedere con:
- le sierologie delle altre epatiti virali (A, C, E e Delta) nonchè dell’HIV
- l’esclusione di altre epatopatie concomitanti
- un ecografia epatica
- la determinazione del grado di fibrosi attraverso fibroscan o biopsia epatica
Nei pazienti con epatite B cronica la biopsia epatica ha il plus di darci importanti informazioni non solo sul grado di fibrosi, ma anche sull’attività dell’epatite stessa (l’infiammazione epatica), informazioni molto rilevanti ai fini della decisione sull’eventuale trattamento. È indicata la vaccinazione antiepatite A se sierologia risulta negativa. Dopo che viene diagnosticata un’epatite B è molto importante che anche i familiari del paziente vengano testati per escludere non infrequenti cluster familiari.
Trattamento dell’epatite B: data la complessità della malattia e la possibile rapida evoluzione della stessa in cirrosi e/o HCC ogni paziente con epatite B deve essere seriamente valutato ai fini di un eventuale trattamento (anche se non tutti i pazienti devono poi essere trattati). La decisione di quando e con che farmaco trattare un paziente richiede la valutazione di uno specialista in epatologia o infettivologia. Nella decisione se trattare o meno entrano in gioco la presenza o meno dell’HBeAg, i livelli di HBV-DNA, i valori delle ALT, la presenza o meno di fibrosi epatica (fibroscan o biopsia epatica) e la presenza o meno di infiammazione epatica (se effettuata la biopsia epatica).
In linea di massima i pazienti da trattare sono:
- Epatite B cronica con HBV-DNA >2000 IU/ml, ALT aumentate e/o almeno moderata necroinfiammazione o fibrosi
- Cirrosi e HBV-DNA anche minimamente detettabile
- HBV-DNA > 20.000 UI/ml e ALT > 2 volte i valori normali (senza biopsia)
- Trattamento da considerare anche se > 30 anni con HbeAg positivo o storia familiare di HCC e/o cirrosi o manifestazioni extraepatiche.
Lo scopo dei trattamenti attualmente disponibili non è un impossibile eradicazione del virus, ma migliorare la sopravvivenza riuscendo a prevenire la progressione verso la cirrosi, l’HCC e la morte (e in questo funzionano molto bene). La terapia previene anche la trasmissione del virus ad altri e nel lungo periodo può favorire la regressione della fibrosi epatica e persino della cirrosi in molti pazienti. Attualmente sono disponibili due classi farmacologiche per il trattamento: l’immunomodulatore interferone alfa peghilato (PEG-INFα) e gli analoghi nucleosidici/nucleotidici (NA) che agiscono come inibitori della trascrittasi inversa dell’HBV polimerasi.
La terapia con PEG-INFα ha una durata limitata nel tempo (48 settimane) ma presenta diversi e talvolta severi effetti collaterali e viene quindi riservata solo ad un subset di pazienti con caratteristiche predittive di successo terapeutico. Molto più usati per la buona efficacia e tollerabilità nonché la facilità di assunzione (1 cp al giorno) sono gli NA, che però devo essere assunti a tempo indefinito (nella maggior parte dei casi ad vitam). I piu’ usati oggi sono l’entecavir (ETV), il tenofovir disoproxil fumarate (TDF) e il tenofovir alafenamide fumarate (TAF). Chiaramente tutti i pazienti in terapia vanno monitorati regolarmente quanto ad efficacia e sicurezza della terapia in atto (per quanto generalmente sicuri, anche gli NA possono avere effetti collaterali a breve e soprattutto lungo termine e dare resistenze virali durature se assunti senza la necessaria compliance).
Prevenzione epatite B: il primo vaccino contro l’epatite B venne approvato dall’FDA nel 1981. Oggi si usano vaccini ricombinanti dotati di un ottimo profilo di sicurezza ed efficacia (90-95% dei vaccinati sviluppa anticorpi anti HBs). Il ciclo vaccinale prevede 3 dosi (tempo 0 e dopo 1 e 6 mesi) ed è importante verificare l’efficacia della vaccinazione con un titolo anti HBs ad un mese dall’ultima dose (un titolo > 100 IU/L indica una copertura ad vitam). Storicamente è stato il primo vaccino in grado di ridurre l’incidenza di un tumore (HCC). In Svizzera dal 2019 la vaccinazione di base contro il virus dell’epatite B è raccomandata di preferenza nei lattanti, con un vaccino combinato esavalente (DTPa-IPV-Hib-HBV) a 2, 4 e 12 mesi di età. Giova ricordare che i paesi a bassa prevalenza di epatite B sono tali unicamente grazie ad estese e perduranti campagne vaccinali e che il vaccino se applicato universalmente potrebbe portare all’eradicazione dell’epatite B (visto che l’uomo è l’unico ospite rilevante per HBV).
Riattivazione dell’epatite B: come si è già detto HBV integra il suo DNA nel nucleo dell’epatocita (e talvolta anche nel DNA umano) e non viene mai completamente eliminato dall’organismo. Nella maggioranza dei pazienti impropriamente definiti “guariti” la malattia in realtà viene solo efficacemente tenuta sotto controllo da parte del sistema immunitario, e questo spiega come in condizioni di immunosoppressione (spontanea ma soprattutto iatrogena) l’epatite B possa riattivarsi. Tale evenienza che comporta non solo l’aumento della carica virale, ma anche una vera e propria epatite acuta con importante transaminite fino a casi di insufficienza epatica (con conseguente interruzione obbligata della chemioterapia e/o della terapia immunosoppressiva, spesso vitale per il paziente), si verifica nel 20-50% dei portatori inattivi di HBsAg e in una percentuale minore ma non trascurabile di pazienti con HBsAg negativo e anti HBc positivo (considerati guariti). È quindi essenziale eseguire uno screening (HBsAg, anti HBc e anti-HBs) prima di qualsiasi terapia immunosoppressiva quali chemioterapie, biologici reumatologici, dermatologici, gastroenterologici, steroidi.
In base al risultato del suddetto screening:
- I pazienti sieronegativi andrebbero subito vaccinati.
- I pazienti con HBsAg o HBV-DNA positivo devono Iniziare un trattamento preventivo con NA (entecavir o tenofovi) PRIMA della terapia immunosoppressiva; va poi valutata l’eventuale sospensione degli NA 12 mesi (18 mesi se rituximab) dopo il termine della terapia immunosoppressiva.
-Per i pazienti anti HBc (± anti-HBs) positivi deve essere determinato l’HBV-DNA. Se negativo va valutata un trattamento preventivo con NA (da attuare sempre in caso di potenti immunosoppressori come il rituximab e l’abatacept) versus una sorveglianza con determinazione dell’HBV-DNA ogni 1-3 mesi per tutta la durata dell’immunosoppressione.

.
Epatite B e gravidanza: non ci devono essere eccezioni allo screening dell’HBsAg durante il primo trimestre di gravidanza. Nelle pazienti risultate positive allo screening (o con nota epatite B) una eventuale terapia antivirale con tenofovir (FDA categoria B) va iniziata nel terzo trimestre solo se HBV-DNA > 200.000 IU/ml. Il taglio cesareo non è indicato e l’allattamento è permesso. Di fondamentale importanza è in ogni caso la vaccinazione attiva e la somministrazione passiva d Immunoglobuline anti HBV al neonato entro 12 ore dal parto. Queste due misure combinate riducono la trasmissione materno-fetale da > 90% a < 10%.
Novità dalla ricerca: finalmente anche l’epatite B è oggetto di una cospicua ricerca mirata al raggiungimento di una cura funzionale che permetta la definitiva eradicazione del virus. Da una parte si stanno quindi identificando nuovi markers che vadano a migliorare la nostra capacità di lettura dell’attività virale quali HBV core-related antigen (HBVcrAg), un marker surrogato dell’attività trascrizionale del cccDNA; HBV-RNA quantitativo che potrebbe diventare un marker clinico per monitorare la replicazione intraepatica durante la terapia antivirale; Anti HBc Ag quantitativo, potenzialmente utile per predire l’efficacia del trattamento. Dall’altra diversi nuovi farmaci e/o nuovi approcci terapeutici sono in diverse fasi di sperimentazione clinica. Come ben illustrato dalla figura sottostante si stanno seguendo strategie molto differenti, molto schematicamente divisibili tra quelle che mirano al sistema immunitario (immunoterapie) e quelle mirate a bloccare i diversi passaggi del ciclo replicativo virale. Al momento non è chiaro quale dei diversi approcci sia il più promettente. Sicuramente la grande mole di studi in corso sarà fonte di grandi novità nei prossimi anni e lascia ben sperare che in un prossimo futuro potremo veramente guarire i nostri pazienti dall’epatite B.
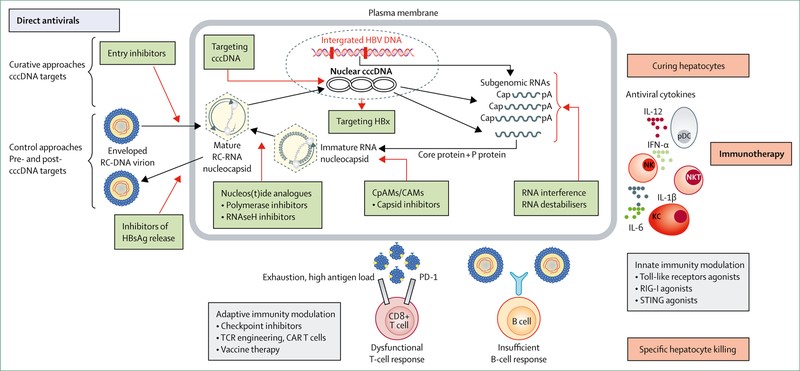
P. Revill et al. Lancet Gastroenterol Hepatol 2019;4:546-558
Fonti:
-EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection
-AASLD 2018 Hepatitis B Guidance
-Hepatology, a clinical textbook, 10th Edition 2020
FOCUS
Calo nei trattamenti dell'epatite B e C a causa della pandemia
Questo è quello che emerge da un sondaggio i cui risultati sono stati presentati durante il Liver Meeting (AASLD Foundation) tenutosi a novembre.
Approfondisci l'argomento cliccando qui.
IN EVIDENZA
7a Ed. - Piattaforma annuale di discussione dell'eccellenza e della sostenibilità del sistema sanitario
Le presentazioni utilizzate durante la conferenza sono online.
Per visualizzarle, clicca qui.
IN AGENDA
Identify and treat lost to follow-up patients with HCV diagnosis
Giovedì, 16 dicembre
ore 18:45
Un webinar per condividere i risultati dello studio, con sessione Q&A.
Scopri di più cliccando qui.