Il bollettino del fegato n.11
n. 20 - Le malattie non virali del fegato n.19 - Dosaggio degli analgesici e cirrosi epatica n. 18 - Fegato e farmaci n. 17 - Il carcinoma epatocellulare (HCC) n. 16 - Fegato grasso n. 15 - Malattie epatiche e abuso di sostanze n. 14 - L'epatite B n.13 - L'epatite autoimmune n.12 SARS-CoV-2 (COVID-19) E FEGATO n.11 CEUS (Contrast Enhanced Ultrasound) n.10 Encefalopatia epatica n.9 - Epatite E n.8 - Morbo di Wilson n.7 - Biopsia epatica n.6 - Iperferritinemia nello studio medico n.5 - Epatopatia alcolica n.4 - Fegato grasso n.3 - Trattamento innovativo dell’ascite n.2 - La colangite biliare primitiva n.1 - I nuovi farmaci contro l'epatite CPRIMO PIANO
La CEUS (Contrast Enhanced Ultrasound) costituisce una delle più grandi innovazioni nell’ambito della diagnostica per immagini ed in particolare in quella ecografica consentendo di arrivare a diagnosi differenziali in tempo reale, in modo non invasivo e senza utilizzare radiazioni ionizzanti.

LA PAROLA ALL'ESPERTO
Dr. med. Manuel Gobbo
Medico accreditato, Epatocentro Ticino
>> Visita il profilo
Uno dei campi di applicazione della CEUS è rappresentato dallo studio del fegato ed in particolare delle lesioni epatiche focali.
Nei pazienti con fegato sano ed in caso di riscontro occasionale di lesione focale la CEUS è utile nella sua caratterizzazione e diagnosi differenziale tra formazione benigna o maligna riducendo notevolmente il ricorso alle tecniche di immagini con “macchine pesanti” quali TAC e RMN. Nei pazienti con cirrosi epatica, la CEUS trova applicazione per la diagnosi dell’epatocarcinoma (HCC), rappresentando ad oggi il gold standard per la diagnosi di noduli HCC con dimensioni superiori al cm.

I mdc sono stati introdotti in ecografia allo scopo di aumentare la sensibilità del color e del power Doppler, in modo soprattutto da poter ottenere maggiori informazioni sulla vascolarizzazione dei parenchimi e delle loro lesioni.
La tecnica abbina l’ecografia con immagini armonico a basso indice meccanico alla somministrazione endovenosa di mezzo di contrasto ecografico (esafluoruro di zolfo, SonoVue).
Il mezzo di contrasto è costituito da una soluzione in cui sono presenti microbolle rilevabili agli ultrasuoni ed hanno una localizzazione intravascolare.
Quando le microbolle vengono colpite dal fascio di ultrasuoni esse “risuonano”, contraendosi ed espandendosi. Il risultato di queste oscillazioni generano ultrasuoni di frequenze variabili chiamate ARMONICHE.
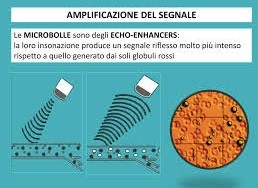
I software per CEUS cancellano o quantomeno riducono il segnale proveniente dalle strutture statiche, per rilevare solo quello proveniente dovuto alla circolazione delle microbolle. Ne deriva una possibilità di valutare il comportamento vascolare delle lesioni a prescindere dall’ecogenicità dello sfondo parenchimale.
Le attuali apparecchiature offrono anche la possibilità di scegliere tra la modalità di visione esclusivamente CEUS e quella in doppio real-time, con campo di vista diviso in due, da un lato l’immagine CEUS e dall’altro quella sincrona ecografica.
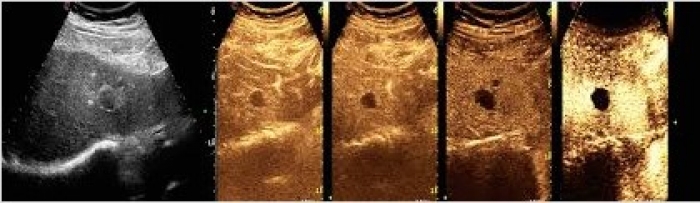
Fasi dell'esame
I mdc ecografici non richiedono digiuno (consigliabile comunque in qualsiasi esame US dell’addome) né test laboratoristi preliminari, poiché non vi è escrezione renale il mdc può essere utilizzato in sicurezza nei paziente con insufficienza renale acuta o cronica. Sono state descritte reazioni allergiche ma sono molto rare 1/1’000-10‘000 come reazioni con extrasistoli, ipotensione, edema polmonare (Kit REA obbligatorio).
Lo studio CEUS deve essere preceduto da un adeguato esame di ecografia basale. La fase precedente all’iniezione serve per scegliere l’approccio di scansione più idoneo cercando di identificare l’accesso che permetta di ottenere il campo di vista più ampio.
In seguito si procede all’incannulamento di una vena periferica, applicando un rubinetto tre vie cui vengono raccordate una siringa con il mdc longitudinalmente, e una con 5-10 ml di soluzione fisiologica trasversalmente che servirà ad evitare che parte del mdc rimanga all’interno del rubinetto.
Il volume iniettato di mdc dipende dal tipo di organo che devo studiare e dall’esperienza dell’operatore, in genere per lo studio del parenchima epatico si usa la dose piena 4,8 ml.
Una volta preparato, al momento indicato, viene iniettato a modi bolo rapido con successivo flash di soluzione fisiologica sempre in bolo rapido.
La sonda viene posizionata nella sede desiderata, si fa inspirare il paziente e si avvia la registrazione. Si attende l’arrivo del mdc che prima opacizzerà le arterie maggiori afferenti poi quelle minori ed infine il parenchima con le strutture venose.
Nel fegato la fase arterioso-dominante va da 10-20 a 30-40 sec. dall’iniezione del mdc, quella portale-dominante da 40-50 a 100-120 sec e quella sinusoidale-dominante da 90-120 fino a 300 sec.

Studiare la vascolarizzazione è importante per svariati scopi:
1. per confermare l’effettiva presenza di una lesione (ad esempio dinanzi ad una modesta disomogeneità di un parenchima o di una sua area);
2. perché l’entità della vascolarizzazione si correla con la probabilità di natura maligna di una lesione (in termini generali, più una lesione è vascolarizzata e più è probabile che essa sia maligna);
3. perché l’entità della vascolarizzazione si correla con il grado di attività e la propensione a metastatizzare della lesione (in termini generali, più è vascolarizzata una lesione, maggiore è la sua tendenza alla metastatizzazione linfatica ed ematogena e peggiore è la sua prognosi);
4. perché definire i rapporti anatomici di una lesione con le strutture vicine e specie i vasi (intesi come manrovesci extralesionali) è fondamentale ai fini della stadiazione e della pianificazione chirurgica;
5. perché l’entità della perdita di vascolarizzazione dopo trattamento si correla con la risposta terapeutica (mancato/ridotto enhancement delle lesioni trattate o di loro parti), specie nel caso di trattamenti come ablazionee percutanea, farmaci angiogenetici, radioterapia ecc.
Conoscendo il comportamento nelle diverse fasi di circolazione del mdc ev delle lesioni stesse, è possibile ottenere informazioni sulla loro natura (benignità vs malignità) o sulla loro istologia (quanto meno sulle lesioni con comportamento “tipico”). Il mdc consente di distinguere ciò che è vascolarizzato da ciò che non lo è, e permette spesso di definire meglio l’effettiva forma e dimensione di una lesione focale.
Vascolarizzazione lesionale
La perfusione (contrast enhancement) viene definita rispetto al parenchima circostante: una lesione può essere descritta come aperfusa, ipoperfusa, isoperfusa e iperperfusa.
Nel caratterizzare una lesione bisogna considerare innanzitutto se, quanto e con quale rapidità questa assuma il mdc all’arrivo di quest’ultimo nell’organo (wash in) e se, quanto e con quale rapidità essa si svuoti , cioè dimetta il mdc stesso (wash out).
WASH IN
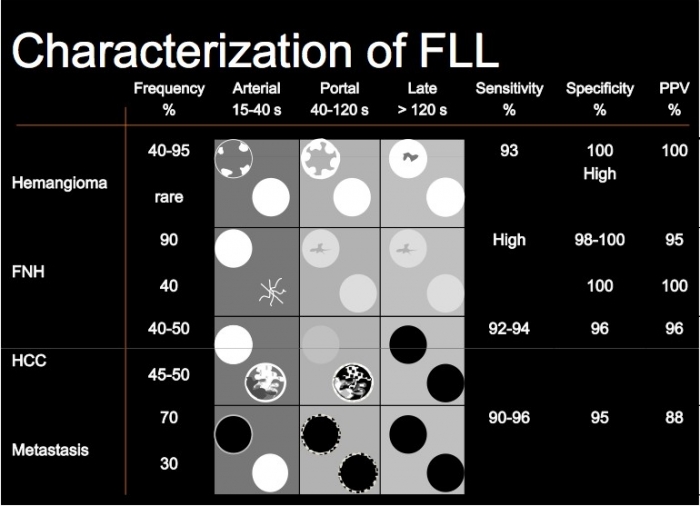
Una volta identificata la presenza della perfusione, e quindi il wash in bisogna analizzare le caratteristiche di quest’impregnazione. Il contrast enhancement può essere omogeneo (angiomi ad alto flusso, FNH, piccoli adenomi, HCC, metastasi), diffusamente eterogeneo (HCC, metastasi, colangiocarcinomi, linfomi), anulare (anello di impregnazione periferica).
L’andamento della perfusione nell’ambito della lesione può essere centrifugo (FNH), centripeto (An-giomi) oppure diffuso/non definibile (altre lesioni). L’evoluzione del bash in nel tempo può essere lenta e progressiva come nel caso degli angiomi a flusso lento, oppure rapida come negli angiomi ad alto flusso, HCC, adenomi e FNH.
WASH OUT
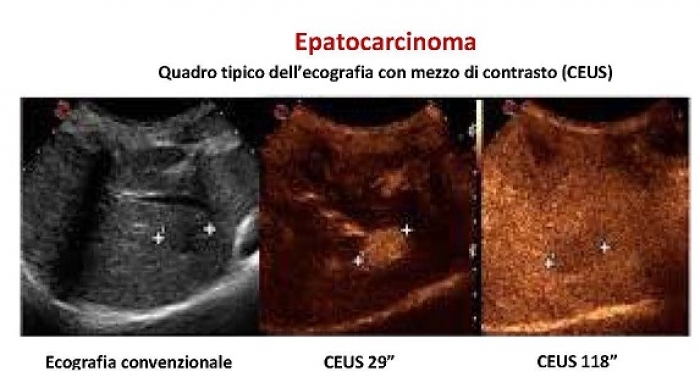
Può essere catalogato come presente o assente; le lesioni che si svuotano in fase venosa sono molto più probabilmente maligne rispetto a quelle che non si svuotano o che lo fanno in modo lento e/o parziale. Nel fegato un aspetto isoperfuso nella fase portale-sinusoidale o, ancor di più uno iper-perfuso (iperecogeno) è indicativo di benignità laddove un aspetto ipoperfuso (ipoecogeno) in fase portale-sinusoidale è altamente predittivo di malignità. Quando la detenzione lesionale è presente bisogna considerare entità e velocità. Le lesioni che hanno spesso uno svuotamento intenso e rapido sono soprattutto le metastasi e i colangiocarcinomi. Le lesioni che invece possono mostrare uno svuotamento progressivo e di moderata entità sono soprattutto HCC ma anche gli adenomi e talvolta anche gli angiomi.

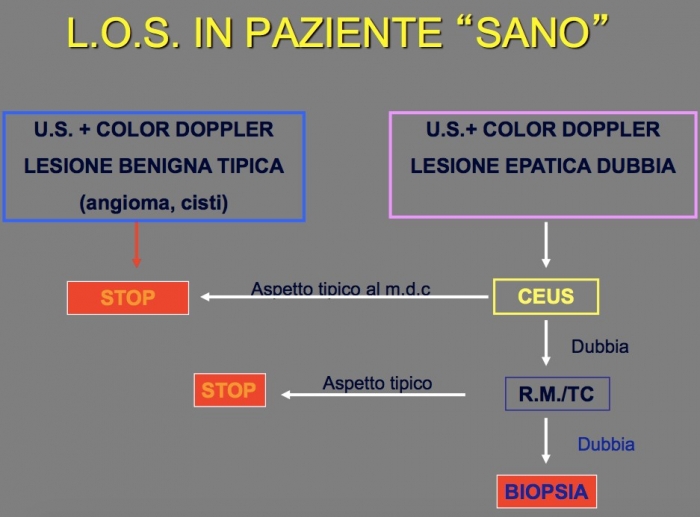
Linee guida utilizzate all’Epatocentro per la lesione occupante spazio in paziente sano
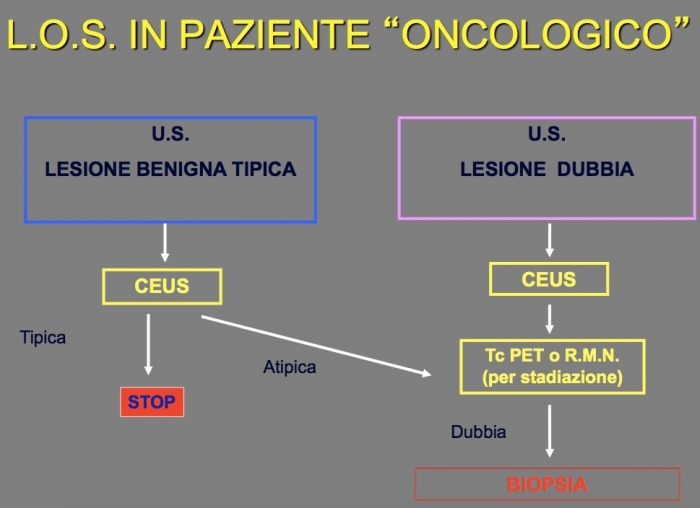
Linee guida utilizzate all’Epatocentro per la lesione occupante spazio nel paziente oncologico
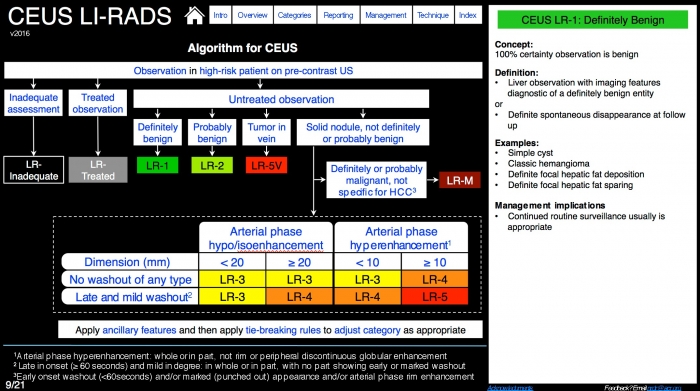
Data l’importanza assunta dall’ecografia con mezzo di contrasto CEUS a livello internazionale si è istituito l’algoritmo US LI-RADS, che non è altro che un sistema per standardizzare la tecnica di immagine, l’interpretazione, la refertazione e la raccolta dati per lo screening o la sorveglianza ecografia in paziente ad alto rischio di sviluppo di HCC.



Limiti dell’ecografia con mezzo di contrasto:
1. Accesso ecografico B-Mode di buona qualità.
2. Presenza unicamente di un contrasto vascolare non parenchima (RMN).
3. La qualità dell’esame dipende dall’operatore (esperienza) e dalla collaborazione del paziente (durata tipica 30-45 minuti).
4. Costo del mezzo di contrasto.
FOCUS
Biobanca Covid-19
In Svizzera la prima biobanca Covid-19 a Lugano grazie alla Fondazione Epatocentro Ticino.
Scarica l'articolo pubblicato sul Corriere del Ticino
IN EVIDENZA
Scienze biomediche USI, Terziroli Beretta-Piccoli nominata docente
Maggiori informazioni nel file allegato
ULTIME NOTIZIE
L'epatite integrata nel programma nazionale HIV
Il SÌ arriva anche dal Consiglio Nazionale.
Maggiori info sul sito di Epatite Svizzera